미국피부과학회, 9년만에 아토피 지침 개정…JAK억제제 권고
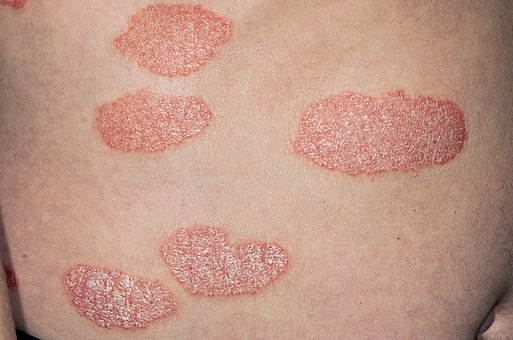
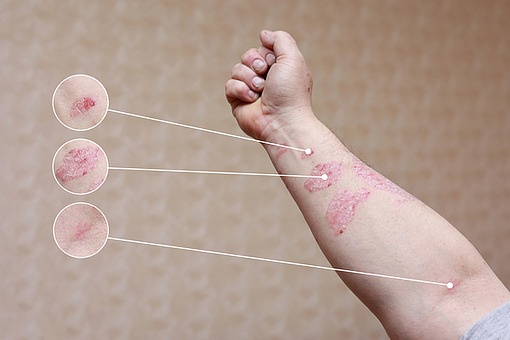
메디칼타임즈=최선 기자미국피부과학회(AAD)가 2014년 이후 9년만에 아토피피부염 관리를 위한 진료 지침을 개정했다. 2014년을 기점으로 다수의 생물학적제제 및 야누스키나제(JAK) 억제제가 출시된 만큼 지침에선 이를 대거 반영, 신규 등장부터 이를 '강력 권고'했다.AAD의 아토피피부염(atopic dermatitis, AD) 진료 지침 개정판이 미국피부과학회지에 7일 공개됐다(doi.org/10.1016/j.jaad.2023.08.102).보통 AD는 보습제나 국소 치료제로 증상이 개선된다. 이번 지침은 광선 치료 및 전신 치료가 필요한 성인의 AD관리를 위한 지침으로 2014년 이후 9년만에 개정됐다.다학제적인 전문가들이 체계적인 검토를 수행, 증거의 확실성을 평가해 권고사항 및 등급을 매기는 GRADE 방식으로 JAK 억제제 및 기타 면역 조절 약물을 포함한 11개의 치료 권고 사항을 개발했다.가장 큰 변화는 생물학적제제와 JAK 억제제의 대거 반영 및 강력 권고다.먼저 생물학적제제로 권고된 것은 두필루맙과 트랄로키누맙. 두필루맙은 인터루킨-4 수용체 α를 표적으로 하는 단일클론항체로 AD에 대해 FDA가 첫 승인한 표적 전신 치료제다.2023년 AAD의 아토피피부염 진료 지침 중 주요 변화 표지침은"성인의 AD 증상 및 삶의 질의 개선에 있어 두필루맙의 효능은 52주 무작위 임상을 포함한 대규모 RCT에서 확인됐다"며 "JAK 억제제인 아브로시티닙과 우파다시티닙과 비교한 단기 RCT에서 두필루맙 표준 투여량(2주마다 300mg)은 더 높은 용량의 JAK 억제제보다 다소 덜 효과적이었다"고 밝혔다.이어 "다만 아브로시티닙 100mg보다는 좀 더 효과적이며, 우파다시티닙 15mg과 동등한 효과를 갖췄다"며 "임상에서 우수한 안전성을 나타냈고 임상 5년 이상 경과한 후에도 주요 안전 우려 사항은 거의 없었다"고 강조했다.가이드라인 제정위원들을 대상으로 선호하는 1차 전신작용제에 대해 조사한 결과 모든 참가자들이 두필루맙을 선호 약제로 지목했다.트랄로키누맙은 인터루킨-13을 표적으로 하는 단일클론항체로 AD에 대해 승인된 두 번째 생물학적제제다.두필루맙과 비슷하게 다수의 임상 시험에서 트랄로키누맙 표준 투여량은 AD 증상 및 삶의 질을 유의하게 개선시켰다.지침은 "트랄로키누맙을 다른 전신 치료법과 직접 비교한 연구는 없다"며 "네트워크 메타 분석에서 습진 영역 및 중증도 지수(EASI) 점수의 변화가 치료 16주째에 두필루맙보다 다소 효과가 떨어지지만 두필루맙과 트랄로키누맙은 모두 강력 권고할만 하다(증거 수준 중간)"고 제시했다.한편 JAK 억제제인 아브로시티닙, 바리시티닙, 우파다시티닙도 강력 권고 목록에 이름을 올렸다. JAK 억제제는 AD, 류마티스 관절염, 건선성 관절염, 탈모증 및 염증성 장질환을 포함한 다양한 질환의 치료를 위해 승인 또는 개발되고 있다.지침은 "우파다시티닙 및 아브로시티닙은 면역억제제, 코르티코스테로이드, 항대사 물질 및 생물학적제제 치료에 실패한 중등도부터 중증의 AD 환자에 사용할 수 있다"며 "3상 임상에서 AD의 징후와 증상을 감소시키고 삶의 질을 개선하는 데 매우 높은 효능을 보여줬다"고 강력 권고의 이유를 설명했다(증거 수준 중간).표준 용량보다 더 높은 용량의 우파다시티닙(일일 30mg)과 아브로시티닙(일일 200mg)은 네트워크 메타 분석에서 현재 사용 가능한 모든 치료법 중에서 EASI 점수를 최대 16주까지 줄이는 데 가장 높은 효과를 나타냈고 이는 두필루맙과 보다 우수했다.미국 FDA의 AD 치료 관련 미승인에도 불구하고 지침은 바리시티닙을 강력 권고했다.지침은 "JAK-1과 2를 모두 억제하는 바리시티닙은 AD에도 효과적"이라며 "유럽에서는 중등도에서 중증의 AD 치료를 위해 승인됐고 미국에서는 다른 면역 상태에서 사용이 가능하지만 FDA는 AD 치료를 위해 승인하지는 않았다"고 말했다.이어 "직접적인 비교 임상은 수행되지 않았지만 네트워크 메타 분석에 따르면 바리시티닙은 우파다시티닙과 아브로시티닙보다 효과가 떨어진다"고 설명했다.면역억제제 사이클로스포린도 AD 적응증에 대한 미국 FDA의 승인을 얻진 못했지만 개정 지침은 이를 조건부 권고했다(증거 수준 낮음).지침은 "사이클로스포린은 신장 장애와 고혈압 부작용과 연관돼 있어 누적 투여량에 따라 신장 손상의 가능성이 증가하기 때문에 장기간 사용은 적합치 않다"며 "건선 적응증에 대한 FDA의 사용 권고에 따라 사이클로스포린을 AD 치료용으로 쓸 경우 12개월 이내로 치료를 제한하라"고 제시했다.이외에 ▲PUVA 광요법 ▲전신 항생제 ▲경구 항히스타민제 ▲몬테루카스트 ▲아프레밀라스트 ▲우스테키누맙 ▲정맥 면역글로불린 ▲인터페론 감마 ▲omalizumab ▲종양 괴사-알파 억제제 ▲전신 칼시뉴린 억제제(사이클로스포린 외)는 권고 여부를 결정할 자료가 부족해 판단을 보류했다.